题文
单质硅是很重要的工业产品。
(1)硅用于冶炼镁,也称硅热法炼镁。根据下列条件:
Mg(s)+ 1/2O2(g)= MgO(s) △H1=-601.8 kJ/mol
Mg(s)= Mg(g) △H2=+75 kJ/mol
Si(s) + O2(g) = SiO2(s) △H3= -859.4 kJ/mol
则2MgO(s)+ Si(s)= SiO2(s)+ 2Mg(g) △H =
Mg-NiOOH水激活电池是鱼雷的常用电池,电池总反应是:Mg+2NiOOH+2H2O=Mg(OH)2+ 2Ni(OH)2,写出电池正极的电极反应式 。
(2)制备多晶硅(硅单质的一种)的副产物主要是SiCl4,SiCl4对环境污染很大,遇水强烈水解,放出大量的热。研究人员利用SiCl4和钡矿粉(主要成分为BaCO3,且含有Fe3+、Mg2+等离子)制备BaCl2·2H2O和SiO2等物质。工艺流程如下:
已知: 25℃ Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mg(OH)2]=1.8×10-11;通常认为残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。回答下列问题:
①SiCl4发生水解反应的化学方程式为_______________________________________。
②若加钡矿粉调节pH=3时,溶液中c(Fe3+)= 。
③若用10吨含78% BaCO3的钡矿粉,最终得到8.4吨BaCl2·2H2O (M=244g/mol),则产率为 。
④滤渣C能分别溶于浓度均为3mol/L的
溶液和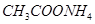
溶液(中性)。请结合平衡原理和必要的文字解释滤渣C能溶于3mol/L的
溶液的原因______。
题型:未知 难度:其他题型
答案
(1)+494.2kJ/mol, NiOOH + H2O + e- = Ni(OH)2 + OH-;
(2)①SiCl4 +3H2O = H2SiO3↓+ 4HCl 或SiCl4 + 4H2O = H4SiO4↓+ 4HCl
②4.0×10-5mol/L, ③ 86.9% (3分)
④Mg(OH)2(s)在溶液中存在的溶解平衡:Mg(OH)2(s)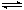
Mg2+(aq)+2OH- (aq),NH4+与OH-结合生成难电离的NH3.H2O,使平衡向正反应方向移动,最终Mg(OH)2溶解。(3分)
解析
(1)根据反应①Mg(s)+ 1/2O2(g)= MgO(s)△H1=-601.8 kJ/mol
②Mg(s)= Mg(g) △H2=+75 kJ/mol③Si(s)+ O2(g)= SiO2(s) △H3= -859.4 kJ/mol,利用盖斯定律:③+②×2—①×2得2MgO(s)+ Si(s)= SiO2(s)+ 2Mg(g) △H =+494.2kJ/mol;Mg-NiOOH水激活电池是鱼雷的常用电池,电池总反应是:Mg+2NiOOH+2H2O=Mg(OH)2+ 2Ni(OH)2,电池正极反应NiOOH得电子生成Ni(OH)2,利用原子守恒和电荷守恒写出电极反应式为
NiOOH + H2O + e- = Ni(OH)2 + OH-;(2)根据题给流程图知,SiCl4发生水解反应生成硅酸沉淀和盐酸,过滤得滤渣A为硅酸,滤液为盐酸,向滤液中加入钡矿粉(主要成分为BaCO3,且含有Fe3+、Mg2+等离子),调节至pH=7,过滤得滤渣B为氢氧化铁,向滤液中加氢氧化钠溶液,调节至pH=12.5,过滤得滤渣C为氢氧化镁,滤液经一系列操作得BaCl2·2H2O。①SiCl4发生水解反应生成硅酸和盐酸,化学方程式为SiCl4 +3H2O = H2SiO3↓+ 4HCl 或SiCl4 + 4H2O = H4SiO4↓+ 4HCl;②Ksp[Fe( OH)3]=4.0×10-38,pH=3的溶液中,氢氧根离子的浓度为1×10-11mol/L,c(Fe3+)=4.0×10-38/(1×10-11)3=4.0×10-5mol/L;③根据原子守恒得关系式:BaCO3——BaCl2·2H2O,若用10吨含78% BaCO3的钡矿粉,理论上生成BaCl2·2H2O为9.66吨,而最终得到8.4吨BaCl2·2H2O (M=244g/mol),则产率为86.9%;④根据题给信息知,滤渣氢氧化镁能溶于3mol/L的NH4Cl溶液的原因Mg(OH)2(s)在溶液中存在的溶解平衡:Mg(OH)2(s)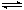
Mg2+(aq)+2OH- (aq),NH4+与OH-结合生成难电离的NH3.H2O,使平衡向正反应方向移动,最终Mg(OH)2溶解。
考点
据考高分专家说,试题“单质硅是很重要的工业产品。 (1)硅用于.....”主要考查你对 [质量守恒定律 ]考点的理解。
质量守恒定律
质量守恒定律:
参加化学反应的各物质质量总和等于反应后生成的各物质质量总和。
化学反应前后,各种原子种类、数目、质量都不改变。
任何变化包括化学反应和核反应都不能消除物质,只是改变了物质的原有形态或结构,所以该定律又称物质不灭定律。
质量守恒定律的本质:
原子是物质质量的最小承担者。故在化学反应中,只要各种原子总数保持不变,则总质量保持不变。所以,质量守恒定律也就等价于元素守恒。
质量守恒定律的适用范围:
①质量守恒定律适用的范围是化学变化而不是物理变化;
②质量守恒定律揭示的是质量守恒而不是其他方面的守恒。物体体积不一定守恒;
③质量守恒定律中“参加反应的”不是各物质质量的简单相加,而是指真正参与了反应的那一部分质量,反应物中可能有一部分没有参与反应;
④质量守恒定律的推论:化学反应中,反应前各物质的总质量等于反应后各物质的总质量
质量守恒定律的应用:
(1)根据质量守恒定律,参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。利用这一定律可以解释反应前后物质的质量变化及用质量差确定某反应物或生成物的质量。
(2)根据质量守恒定律,化学反应前后元素的种类和质量不变,由此可以推断反应物或生成物的组成元素。
(3)据质量守恒定律:化学反应前后元素的种类和数目相等,推断反应物或生成物的化学式。
(4)已知某反应物或生成物质量,根据化学方程式中各物质的质量比,可求出生成物或反应物的质量。




