题文
室温下,将1.00mol· L-1盐酸滴入20.00mL1.00mol· L-1氨水中,溶液pH随加入盐
酸体积变化曲线如图所示。下列有关说法正确的是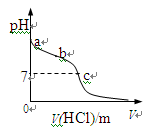
A.a点:pH=14B.b点:c(NH4+) +c(NH3·H2O) = c(Cl-)C.c点:水电离出的c(H+) = 1.0×10-7mol· L-1D.c点后,溶液中离子浓度大小关系一定为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
题型:未知 难度:其他题型
答案
C
解析
氨水是弱碱,1.00mol· L-1氨水中c(OH-)<1.00mol· L-1,pH>14,A错误;当加入盐酸20mL时,盐酸与氨水恰好完全中和,此时溶液呈酸性,所以c点盐酸的体积小于20mL,c点pH=7,水电离的c(H+)=1.0×10-7mol· L-1,C正确;b点为氨水与氯化铵溶液的混合物,c(NH4+) +c(NH3·H2O) > c(Cl-),B错误;c点后,溶液呈酸性,离子浓度关系可能为c(Cl-)>c(NH4+)>c(H+)>c(OH-)
或c(Cl-)>c(H+)>c(NH4+)>c(OH-),D错误。
点评:盐酸与氯化铵的混合溶液中,离子浓度大小可能为c(Cl-)>c(NH4+)>c(H+)>c(OH-)
或c(Cl-)>c(H+)>c(NH4+)>c(OH-)。
考点
据考高分专家说,试题“室温下,将1.00mol· L-1盐酸滴.....”主要考查你对 [离子共存 ]考点的理解。
离子共存
离子共存:
所谓离子共存实质上就是看离子间是否发生反应。若离子在溶液中发生反应,就不能共存。
因能发生氧化还原反应而不共存的离子有:
(注:“√”表示能发生反应,“×”表示不能发生反应)
S2-
SO32-
I-
Fe2+
Br-
Cl-(H+)
MnO4-
√
√
√
√
√
√
ClO-
√
√
√
√
√
√
NO3-(H+)
√
√
√
√
√
×
Fe3+
√
√
√
×
×
×
因能发生复分解反应而不共存的离子有:
- 离子间相互结合生成难溶物或微溶物
Ba2+、Ca2+CO32-、SO32-、SO42-Ag+CO32-、SO32-、Cl- - 离子间相互结合生成气体或挥发性物质
H+CO32-、HCO3-、SO32-、HSO3-、S2-、HS-OH-NH4+ - 离子间相互结合生成弱电解质
H+ CO32-、SO32-、S2-、CH3COO-、F-弱酸OH-NH4+、Al3+、Fe3+、Cu2+、Mg2+弱碱H+水
因能发生双水解的离子有:
Al3+CO32-、HCO3-、SO32-、HSO3-、S2-、HS-、AlO2-、ClO-Fe3+CO32-、HCO3-、AlO2-、ClO-NH4+SiO32-、AlO2-
因发生络合反应而不共存的离子有:
Fe3+ SCN-Ag+、Cu2+NH3·H2O
null
null
null
判断离子是否共存的几种情况:
(1)发生复分解反应,离子不能大量共存。
①有气体产生 如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
②有沉淀生成 如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
③有弱电解质生成 如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-与H+不能大量共存;
一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。
(2)发生氧化还原反应,离子不能大量共存
①具有较强还原性的离子不能与具有较强氧化性的离子大量共存 如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
②在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存 如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;
SO32-和S2-在碱性条件下可以共存,但在酸性条件下由于发生2S2-+SO32-+6H+=3S↓+3H2O不能共存 ;H+与S2O32-不能大量共存。
(3)能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
(4)溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存。
主要题目要求的限定:
(1)酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液、由水电离出的H+或OH-=1×10-10mol/L的溶液等。
(2)溶液的颜色:有色离子MnO4-(紫色)、Fe3+(棕黄)、Fe2+(浅绿)、Cu2+(蓝)、Fe(SCN)2+(红)、Fe(SCN)63-(血红)。
(3)要求“大量共存”还是“不能大量共存”。




