题文
(6分)(2012•重庆)下列叙述正确的是( )A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
题型:未知 难度:其他题型
答案
C
点击查看溶液知识点讲解,巩固学习
解析
A、当盐酸和氨水恰好中和生成NH4Cl时,铵根离子水解呈酸性;
B、醋酸是弱电解质,加水稀释促进电离,平衡状态下离子浓度减小;
C、饱和石灰水中加入氧化钙会与水反应生成氢氧化钙,析出晶体后溶液仍是饱和溶液离子浓度不变;
D、胶体是电中性的分散系;
解:A、当盐酸和氨水恰好中和生成NH4Cl时,由于铵根离子水解呈酸性,若使溶液呈中性,应继续向溶液中加入氨水,故溶液中的溶质是NH4Cl和NH3•H2O,故A错误;
B、向稀醋酸中加水时,醋酸的电离平衡正向移动,醋酸的电离程度增大,但c(H+)减小,故pH增大,故B错误;
C、温度不变,Ca(OH)2的溶解度不发生变化,故饱和石灰水中c(OH﹣)的浓度不变,所以pH不变,故C正确;
D、氢氧化铁胶体的胶体粒子带有正电荷,但氢氧化铁胶体呈电中性,故D错误;
故选C.
点评:本题考查了酸碱反应的溶液酸碱性判断,弱电解质稀释溶液PH变化,饱和溶液的离子浓度分析,胶体性质的应用,题目难度中等.
考点
据考高分专家说,试题“(6分)(2012•重庆)下列叙述正确的.....”主要考查你对 [溶液 ]考点的理解。
溶液
溶液:
一种或几种物质分散到另一种物质中,形成均一、稳定的混合物,分散质粒子的直径d<10-9m
电中性原理:
溶液对外是不显电性的,所以,在电解质的溶液中,阳离子所带正电荷总数=阴离子所带负电荷总数。
如含K+、Al3+、H+、Cl-、SO42-的溶液中,必然存在c(K+)+3c(Al3+)+c(H+)=c(Cl-)+2c(SO42-)。
溶液的稀释定律:
- 稀释前后溶液中溶质的物质的量不变: c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)
- 稀释前后溶液中溶质的质量不变: ρ(浓溶液)V(浓溶液)w%(浓溶液)=ρ(稀溶液)V(稀溶液)w%(稀溶液)
null
null
容量瓶的使用:
1.容量瓶的使用及注意事项
(1)在使用前首先要检查是否漏水。
具体操作如下:
(2)检查合格后,用蒸馏水洗涤干净。
(3)四个“不能”
①不能将固体或浓溶液直接在容量瓶中溶解或稀释。
②不能作为反应容器或长期贮存溶液。
③容量瓶的容积是在瓶身所标温度下确定的,因而不能将过冷或过热的溶液转移到容量瓶中。
④只能配制容量瓶上规定容积的溶液,即不能配制任意体积的溶液。
2. 误差分析
分析依据,以配置NaOH溶液为例,在进行误差分析时,根据实验操作弄清是“m”还是“V”引起的误差,再具体分析,具体情况如下: 能引起误差的一些操作因变量c(mol/L)mV砝码与物品颠倒(使用游码)减小——偏低称量时间过长减小——用滤纸称NaOH减小——向容量瓶注液时少量溅出减小——未洗涤烧杯和玻璃棒减小——定容时,水多用滴管吸出减小——定容摇匀后液面下降再加水——增大定容时仰视刻度线——增大砝码沾有其他物质或已生锈增大——偏高未冷却至室温就注入容量瓶定容——减小定容时俯视读数——减小称量前小烧杯内有水————不变定容后经振荡、摇匀,静置液面下降————
特别提醒:
(1)定容、摇匀后液面下降也不要补加蒸馏水,否则结果会偏低。
(2)定容时俯视、仰视对结果的影响。
①仰视刻度线(图1),导致溶液体积偏大。
②俯视刻度线(图2),导致溶液体积偏小。
为减小误差务必按:眼睛视线→刻度线→凹液面最低处的次序,做到“三点一线”。
一定物质的量浓度的溶液的配置:
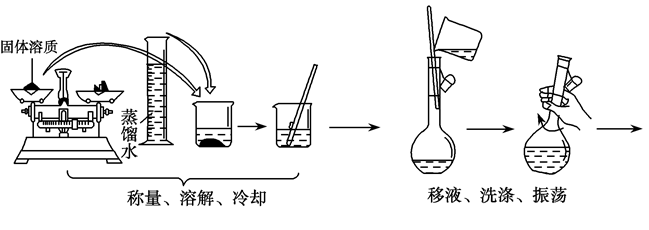
1.主要仪器 (1)托盘天平:可精确至0.1g,称量前先调零,称量时物品放在左盘,砝码放在右盘。
(2)容量瓶:配制溶液的专用精确容器,瓶上标有温度、容积和刻度线。
(3)其他仪器:量筒、烧杯、玻璃棒、胶头滴管等。
2.配制过程
配制过程如下:
(2)检查合格后,用蒸馏水洗涤干净。
(3)四个“不能”
①不能将固体或浓溶液直接在容量瓶中溶解或稀释。
②不能作为反应容器或长期贮存溶液。
③容量瓶的容积是在瓶身所标温度下确定的,因而不能将过冷或过热的溶液转移到容量瓶中。
④只能配制容量瓶上规定容积的溶液,即不能配制任意体积的溶液。
2. 误差分析
分析依据,以配置NaOH溶液为例,在进行误差分析时,根据实验操作弄清是“m”还是“V”引起的误差,再具体分析,具体情况如下: 能引起误差的一些操作因变量c(mol/L)mV砝码与物品颠倒(使用游码)减小——偏低称量时间过长减小——用滤纸称NaOH减小——向容量瓶注液时少量溅出减小——未洗涤烧杯和玻璃棒减小——定容时,水多用滴管吸出减小——定容摇匀后液面下降再加水——增大定容时仰视刻度线——增大砝码沾有其他物质或已生锈增大——偏高未冷却至室温就注入容量瓶定容——减小定容时俯视读数——减小称量前小烧杯内有水————不变定容后经振荡、摇匀,静置液面下降————
特别提醒:
(1)定容、摇匀后液面下降也不要补加蒸馏水,否则结果会偏低。
(2)定容时俯视、仰视对结果的影响。
①仰视刻度线(图1),导致溶液体积偏大。
②俯视刻度线(图2),导致溶液体积偏小。
为减小误差务必按:眼睛视线→刻度线→凹液面最低处的次序,做到“三点一线”。
一定物质的量浓度的溶液的配置:
1.主要仪器 (1)托盘天平:可精确至0.1g,称量前先调零,称量时物品放在左盘,砝码放在右盘。
(2)容量瓶:配制溶液的专用精确容器,瓶上标有温度、容积和刻度线。
(3)其他仪器:量筒、烧杯、玻璃棒、胶头滴管等。
以配制480mL1mol·L-1NaCl溶液为例:
(1)所需容量瓶规格:500mL容量瓶。
(2)若用托盘天平应称量NaCl粉末29.3g。
(3)溶解过程中玻璃棒的作用为:搅拌加速溶解。
(4)移液
①移液前需要将溶液冷却至室温。
②移液中玻璃棒的作用为:引流。
③移液时需要进行的操作为:将烧杯中溶液注入容量瓶中,用少量蒸馏水洗涤烧杯内壁2~3次并将洗涤液也转入容量瓶中,轻轻摇动容量瓶,使溶液混合均匀。
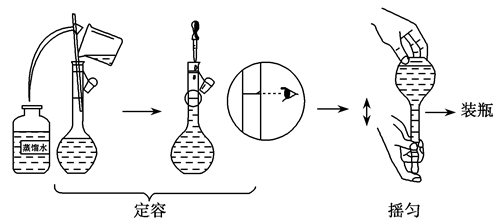
(5)定容
①当液面距瓶颈刻度线1~2cm时改用胶头滴管滴加蒸馏水。
②定容时要平视刻度线,直到凹液面最低点与刻度线相切。
(6)摇匀,转入试剂瓶保存
假如其他操作均准确无误,分析下列情况对配制浓度的影响。
①定容时俯视观察刻度线:偏高;
②移液时,对用于溶解NaCl的烧杯没有洗涤:偏低;
③定容后,将容量瓶振荡摇匀,静置后发现液面低于刻度线,又补水至刻度线:偏低。
溶液配制过程中的“四个数据”:
数据要求或解释药品的质量实验室中一般用托盘天平称量药品,而托盘天平只能称准0.1g,所以记录数据时只能保留小数点后一位数字。如题中NaOH的质量为10.0,不能写为10.00g容量瓶的规格 (1)选择容量瓶的规格时应该与所配溶液体积相等或稍大
(2)回答补充仪器的问题时应该注明容量瓶的规格,如应该回答“500ml容量瓶”,不能只回答“容量瓶”。